
Test de Hémocompatibilité ISO 10993
ISO 10993-4:2017 Interprétation des normes relatives aux tests d'hémocompatibilité
Les dispositifs médicaux qui entrent en contact direct ou indirect avec le sang humain en circulation doivent subir des tests d'hémocompatibilité si les données sont insuffisantes pour démontrer la conformité aux exigences de compatibilité sanguine. La norme ISO 10993-4:2017 est une norme de référence clé pour ces tests. Aujourd'hui, le laboratoire chinois JJR interprétera les exigences de cette norme et étudiera les protocoles de test.
Présentation des tests d'hémocompatibilité
Les tests d'hémocompatibilité évaluent les effets des dispositifs ou matériaux médicaux en contact avec le sang ou les produits sanguins. Lors de la sélection et de la conception des protocoles de test, des facteurs tels que la conception du produit, l'utilisation clinique, l'environnement et l'analyse risques-bénéfices doivent être pris en compte.
La norme ISO 10993-4:2017, en tant que référence essentielle, comprend principalement trois composants :
1. Classification des dispositifs médicaux en contact avec le sang.
2. Caractéristiques fondamentales pour évaluer les réponses sanguines.
3. Sélection des méthodes d’essai.
Classification des dispositifs en contact avec le sang
Les dispositifs sans contact avec le sang font référence à ceux qui n’interagissent pas directement ou indirectement avec le sang qui reste dans le corps ou qui y est renvoyé, tels que les réactifs de diagnostic in vitro et les tubes de prélèvement sanguin.
Les dispositifs de communication externes interagissent généralement avec le sang circulant et se connectent au système vasculaire humain. On peut citer comme exemples les dispositifs de prélèvement sanguin, les cathéters, les équipements de stockage ou de transport du sang comme les poches de sang et les tubes de transfusion, les cathéters vasculaires et les rallonges intraveineuses. On peut également citer les dispositifs d'athérectomie, les systèmes de surveillance sanguine, les circuits de pontage cardiopulmonaire, les équipements de séparation thérapeutique du sang, les oxygénateurs à membrane extracorporelle, les dispositifs de dialyse, les dispositifs d'intervention cardiaque et les fils-guides vasculaires.
Les dispositifs implantables impliquent un contact prolongé avec le sang et comprennent les anneaux d'annuloplastie, les shunts artérioveineux, les moniteurs implantables, les dispositifs d'assistance ventriculaire, les cœurs artificiels, les dispositifs d'embolisation, les greffes vasculaires synthétiques, les défibrillateurs implantables, les sondes de stimulateur cardiaque, les stents et les produits similaires.
Caractéristiques des réactions sanguines
Après avoir identifié la catégorie de l'appareil, il est essentiel de comprendre les caractéristiques de réaction sanguine du produit pour sélectionner les méthodes de test appropriées. Deux points critiques doivent être notés :
- La norme fournit un organigramme de décision pour déterminer si des tests d'hémocompatibilité sont nécessaires.
- La norme répertorie des exemples d'appareils avec les catégories de test correspondantes.
Répondre aux quatre questions suivantes peut aider à déterminer si un test d’hémocompatibilité est nécessaire :
1. Le dispositif entre-t-il en contact direct ou indirect avec le sang en circulation ? Dans le cas contraire, cette norme ne s'applique pas ; dans l'affirmative, passez à la question suivante.
2. Les matériaux utilisés dans le dispositif correspondent-ils à ceux des produits commercialisés en termes de traitement, de structure, de propriétés physicochimiques, de méthodes de stérilisation et d'utilisation clinique ? Si tous les éléments correspondent, aucun test n'est nécessaire ; dans le cas contraire, poursuivez.
3. Les différences peuvent-elles être évaluées et jugées acceptables ? Si oui, les tests sont inutiles ; si non, une évaluation plus approfondie des risques est nécessaire.
4. Les données d'évaluation des risques sur la compatibilité sanguine sont-elles acceptables ? Si oui, les tests ne sont pas nécessaires ; dans le cas contraire, des tests sont requis conformément aux directives en vigueur.
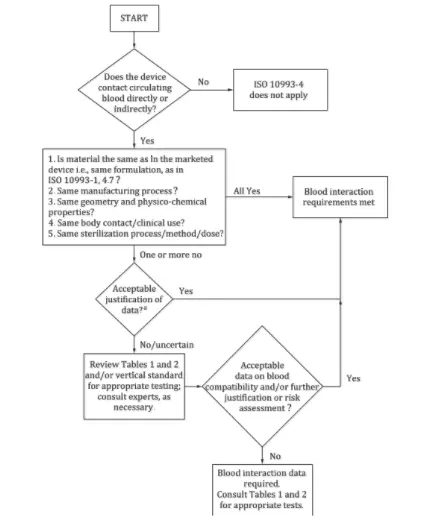
Parmi les exemples de dispositifs nécessitant des tests, on peut citer les dispositifs de surveillance sanguine, qui peuvent nécessiter des tests d’hémolyse, de coagulation, d’activation plaquettaire et d’hématologie.
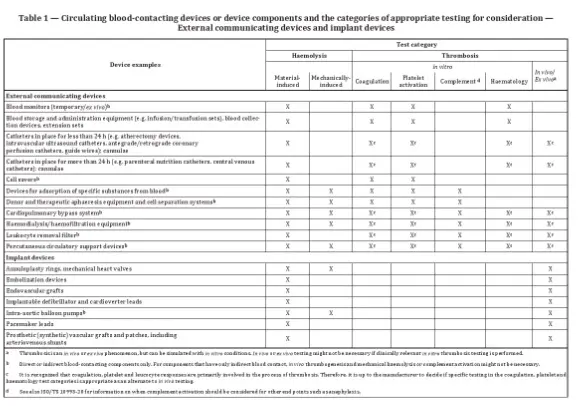
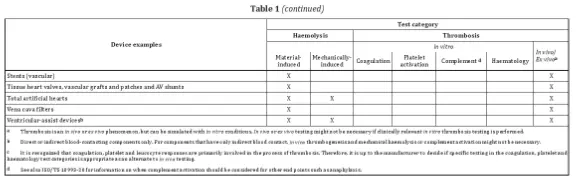
Les paramètres à prendre en compte comprennent la conception structurelle, les propriétés physicochimiques, les caractéristiques de surface, les conditions de stérilisation, la durée de contact, la température et les conditions de circulation sanguine ou d'anticoagulation. Pour les produits implantables, les tests doivent simuler étroitement les conditions cliniques.
Description des méthodes d'essai
En général, les tests d’hémocompatibilité comprennent deux catégories principales :
1. Tests d'hémolyse : ils peuvent être à médiation matérielle ou mécanique.
2. Tests de thrombose : ceux-ci comprennent des tests in vitro de coagulation, d'activation plaquettaire et d'activation du complément, ainsi que des tests in vivo et ex vivo.
Les principaux éléments à prendre en compte pour les tests in vitro comprennent l’hématocrite, le type et le dosage de l’anticoagulant, la préparation de l’échantillon sanguin, la température, le pH, les conditions d’écoulement et les rapports sang/surface.
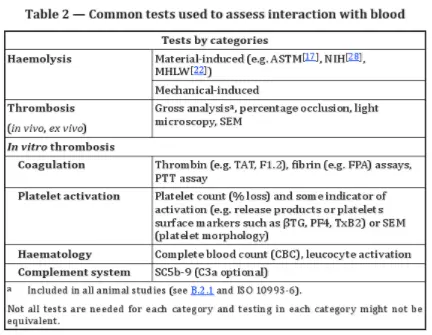
Les tests ex vivo sont essentiels pour les dispositifs extracorporels comme les systèmes de dialyse. Ces tests permettent de surveiller l'adhésion plaquettaire, la formation de thrombus et le dépôt de fibrinogène. Les variations du flux sanguin en temps réel peuvent indiquer le dépôt de thrombus et l'embolisation.
Pour les dispositifs implantables tels que les stents vasculaires, les études in vivo sur les animaux doivent simuler les conditions cliniques. Les principaux critères d'évaluation comprennent la perméabilité du dispositif et l'évaluation histopathologique après son retrait. Des techniques avancées telles que l'angiographie ou l'échographie intravasculaire (IVUS) peuvent également être utilisées.
Conclusion
La norme ISO 10993-4:2017 décrit la classification des dispositifs médicaux en contact avec le sang, les caractéristiques fondamentales des réactions sanguines et les méthodes d'essai normalisées. Toutefois, des directives détaillées sur la conception des essais, tels que les essais de thrombose in vivo ou d'activation plaquettaire, nécessitent de consulter les annexes A à G de la norme.
Références
[1] ISO 10993-4:2017 Évaluation biologique des dispositifs médicaux -- Partie 4 : Sélection des essais pour les interactions avec le sang
Email:hello@jjrlab.com
Write your message here and send it to us
 Qu'est-ce qu'un certificat RoHS ?
Qu'est-ce qu'un certificat RoHS ?
 Qu'est-ce que le test RoHS ?
Qu'est-ce que le test RoHS ?
 Que signifie la certification RoHS ?
Que signifie la certification RoHS ?
 Qu'est-ce que le rapport de test UL2054 ?
Qu'est-ce que le rapport de test UL2054 ?
 Qu'est-ce que les tests EMI/EMC ?
Qu'est-ce que les tests EMI/EMC ?
 Qu'est-ce qu'un test d'immunité CEM ?
Qu'est-ce qu'un test d'immunité CEM ?
 Qu'est-ce que la certification Amazon UL 2089?
Qu'est-ce que la certification Amazon UL 2089?
 Qu'est-ce que la certification UL1647?
Qu'est-ce que la certification UL1647?
Leave us a message
24-hour online customer service at any time to respond, so that you worry!




